[ 指定コメント (No.4158) の関連スレッドを表示しています。 ]
|
二つ目,描画の方法です.交尾器などを顕微鏡下でスケッチする場合に方眼ミクロメーターを使って方眼紙に描いていきます.その際にエタノールのシャーレに入れて観察するのが像としてはいいのですが,難しい構造の場合には描画に時間がかかり,時間につれて蒸発して液面が下がって像が視野の中で動きます.水やグリセリンはその心配が少ないか全くないので,私は最近グリセリンを使っています(難点は埃が液面に浮くことです.エタノールでは沈みます;中性洗剤を少量入れると解決するかもしれません).それでも交尾器を期待するアングル(真横とか左右対称の背面とか)に保つのはなかなかうまくいきません.従来は脱脂綿やガーゼをシャーレの底に敷いて,その繊維に材料を絡ませて動かないようにしていましたが,微小な材料の場合は繊維のほうが太すぎて繊維の間に沈んでしまったりしてうまくありません.一時は眼鏡拭き用の超極微細繊維の布を切って繊維を毛羽立てて使っていましたが,あまり感心しません.最近到達したのは,やはり超微細繊維ですが,布ではなくて薄い紙状(?)にしたクロス素材です.これを適当な大きさに切って,尖ったピンセットの先などで繊維をほぐして毛羽立て,これをシャーレの底に動かないように敷いたペフ板に微針などで固定しておきます.これにグリセリンを満たして,グリセリン保存の交尾器などをこの素材の繊維に絡ませると驚くほど安定が良くて,微小な交尾器などでも全く動かないでアングルを保てます.安心して描画が出来るので大変便利です.この素材はたまたま携帯クリーナーとして町角で配布されていたのを用いた結果です.素材が入手できたら是非試みることをお薦めします.描画に限らず写真撮影でももちろん使えます.
アノニモミイア様.
私も交尾器の固定には苦労しました. 色々と試行錯誤を重ねた結果,現在はグリセリンゼリー(glycerin jelly)を使用しています. ホールスライドグラスに,数種類の隙間でカバーガラスを掛けたセットをあらかじめ用意しておき,目的の交尾器よりやや大きめの隙間のセットを少し暖めて交尾器を滑り込ませ,実体顕微鏡下で交尾器の角度を調整しながら冷やした後,描画や撮影をしています. (ある程度調整した後,きれいに拭いた鉄板などの上に載せてやると早く固定出来ます) また,このカバーガラスとの隙間を左右で異なるように設定しておくと,殆ど変形させずにカバーガラス直下に交尾器をセット出来ますので,400倍での検鏡もある程度可能です.(私は,Bioquipのプラスチックスペーサーを使用して,1.0-0.75, 0.75-0.5, 0.5-0.25, 0.25-0等の隙間のセットを作ってスライドグラスボックスに保管してます.)
アノニモミイア様、市毛様
貴重なテクニック情報ありがとうございます。 実は、私も最近グリセリンゼリーを試みてみようと思っていたところでした。私の場合、ハエの幼虫をアルカリで処理して、さまざまな方向から観察するのに際して、特に終気門の形質を幼虫を倒立させて観察するのに、粘性の高い媒体がよさそうだと思ってグリセリンゼリーを考え始めていたのです。 なお、私の古巣の海洋生物の分野ですと、二枚貝の浮遊幼生時代の貝殻をグリセリンゼリーの中に保持して保存・観察を行います。 節足動物分野ですと、昆虫では市毛様以外にグリセリンゼリーを使っておられる方を寡聞にして知らないのですが、ミズダニの標本では通常の封入剤が適せず、グリセリンゼリーで永久プレパラートを作るのが通例です。
市毛さん,グリセリンジェリーの方法,有難うございました.試みてみたいと思います.実体顕微鏡で観察する限りでは,私が示した方法は簡便で,どなたでも容易に入手できるとは思いますが,グリセリンジェリーの方法は光学顕微鏡(透過光の一般的な)での観察の際の材料固定には非常に有効だと推察します.ネットでみると花粉のマウントにはグリセリンジェリーが一般的に使われているようですね.それで二つ質問です.宜しくお願いします.
1.グリセリンジェリーとは何ですか.またその入手方法は. 2.あなたの記述の3番目のパラグラフの部分をより具体的に分りやすく説明してください. 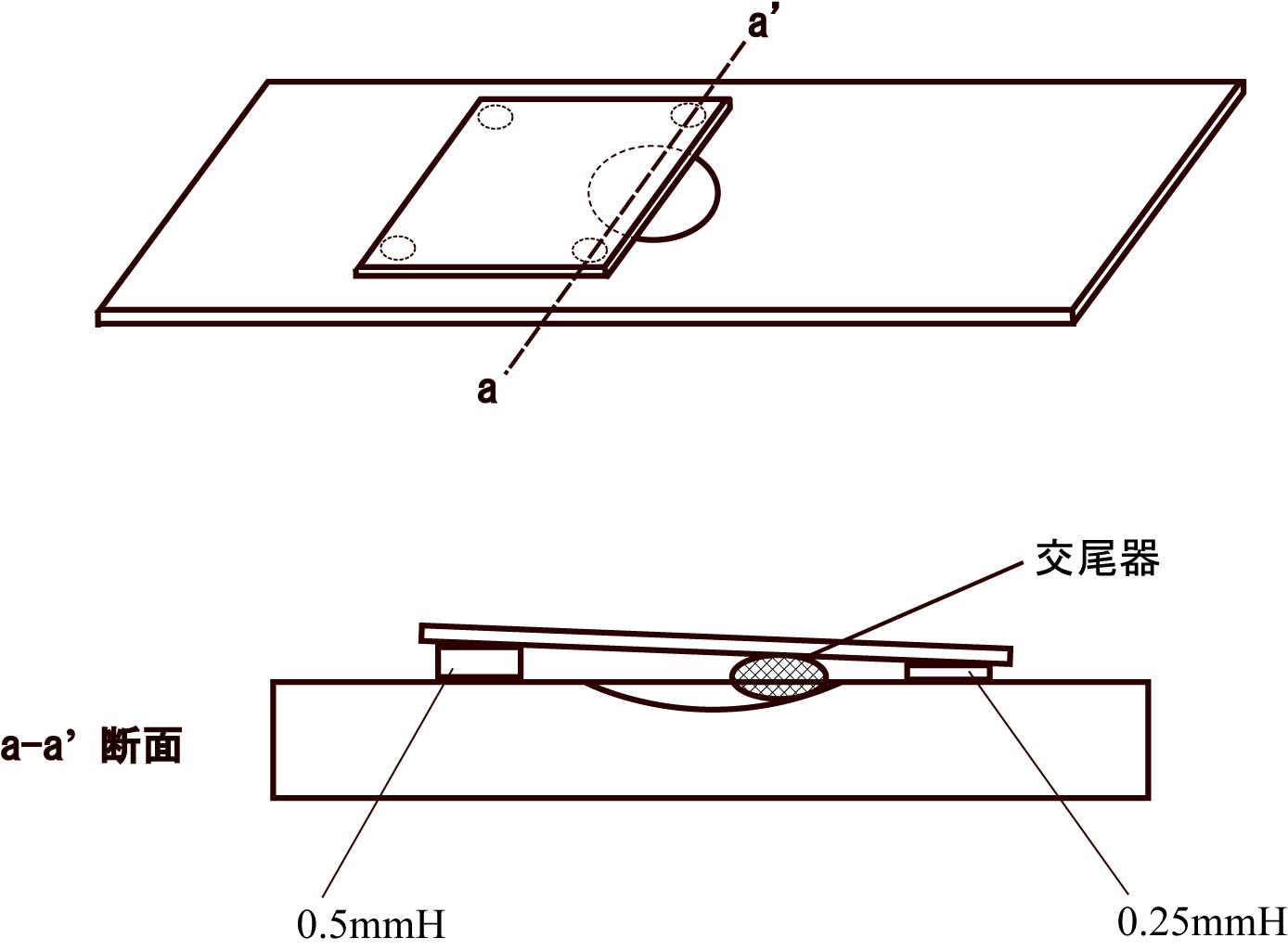 1. 1.グリセリンゼリーは,市販の家庭用粉末ゼラチンを水に溶かしたものにグリセリン を加えたものです. 防腐剤としてフェノールを少し加えています. 下記HPの,11.グリセリン・ゼラチンの一番上の方法で作っています. http://www2u.biglobe.ne.jp/~gen-yu/recipe.html#B10 ろ過がうまく出来なかったので,繊維状の異物が多少混じっていますが,あまり気にせずに使用してます. 2. 3番目のパラグラフの部分は,"左右で異なる"ではなく"手前と奥側とで異なる"でした. 図のようにスライドグラスとカバーガラスの間に入れるスペーサーを,意図的に手前と奥側の高さを違えたものを用意しておくということです. しかし,これはユーパラルで固定していた時代の名残で,グリセリンゼリーだと非常に短時間で硬化するので,硬化中に交尾器があまり動かないので必要ないようです. 以前は,ユーパラルで硬化中に交尾器が動いてしまう時に,カバーガラスの高さを違えたものに変えてみると,手前と奥とでホールの傾斜等が異なるためか,何箇所か位置をずらしてみると上手く固定できることが何度もあったので,習慣的に使っていました. 当然,カバーガラス直下に交尾器が位置するように固定出来ますので,作動距離の短い40倍の対物レンズでも交尾器の広い範囲を観察できます. (通常の40倍対物レンズは作動距離が0.65mm程ですので,交尾器の上側から約0.48mmの位置までが観察可能) 上手く固定出来るなら,このようなおかしなものは必要ないようです.
市毛様,詳細なご説明有難うございました.実際に使ってみればわかることも多々あるかと思いますので,先ずは試みてみます.それにしても,ご紹介いただいたサイトには多様な封入方法が説明されていて,いずれも参考になります.水あめ法というのもあって,これについては以前に私もハチミツに封入したらどうか,などと考えたことがあるので,納得です.
生物顕微鏡での描画については,安定した角度のものをデジカメで撮影して,この画像をもとにして外形などアウトラインを描いて,それからじっくり細部を観察しながら記入していく,という方法をとっていました.ホールスライドの底面の傾斜とカバーグラスの間隔を適宜利用して,最善のアングルをとるようにしても,どうしても10分,20分とたつと動いてしまうので,上記のようにしていました. 今回の方法ですと,最善なアングルの状態でグリセリンジェリーをどのようにして冷やし,固めるかにテクニックが必要かなと想像しています.
ウミユスリカ様.
確かに,日本では昆虫などの固定にグリセリンゼリーを使用している例は聞いたことがなく,この方法にたどり着くまで色々と試行錯誤しました. 海外のMicroscope-UK等を見ると,結構使われているようです. http://www.microscopy-uk.org.uk/mag/artaug03/wdpart4.html アノニモミイア様. グリセリンゼリーを使うようになってからは,描画中に交尾器が動いてしまうことはかなり減りました. しかし,夏場は室温が高いためか冷却不足となって動く頻度が上がりますので,アイスノンにタオルを巻いた物の上に乗せて十分冷やしてから描画するようにしてました. また,半ば固まった状態でも多少動かせる場合が多いので,これを利用して微妙な角度を調整する場合もあります.調整後に急冷する必要がある場合があります. 一度,描画を中断して翌日に続きを描いたこともありますが,あまり問題なく描けたような気がします. |
- Joyful Note -
- Antispam Version -